In questo approfondimento: come funziona questa antica pratica ora utilizzata contro il nuovo coronavirus SARS-CoV-2, quali sono i casi di studio nel mondo – tra Cina, Europa e Stati Uniti d’America – e cosa si sa finora della sua efficacia e dei suoi limiti.
–Cos’è il “plasma convalescente”
–La sperimentazione tra Cina, Europa e Stati Uniti
–Plasma convalescente e COVID-19, cosa si sa finora
-La FDA ha sospeso l’approvazione di emergenza per la cura al plasma contro la COVID 19
Cos’è il “plasma convalescente”
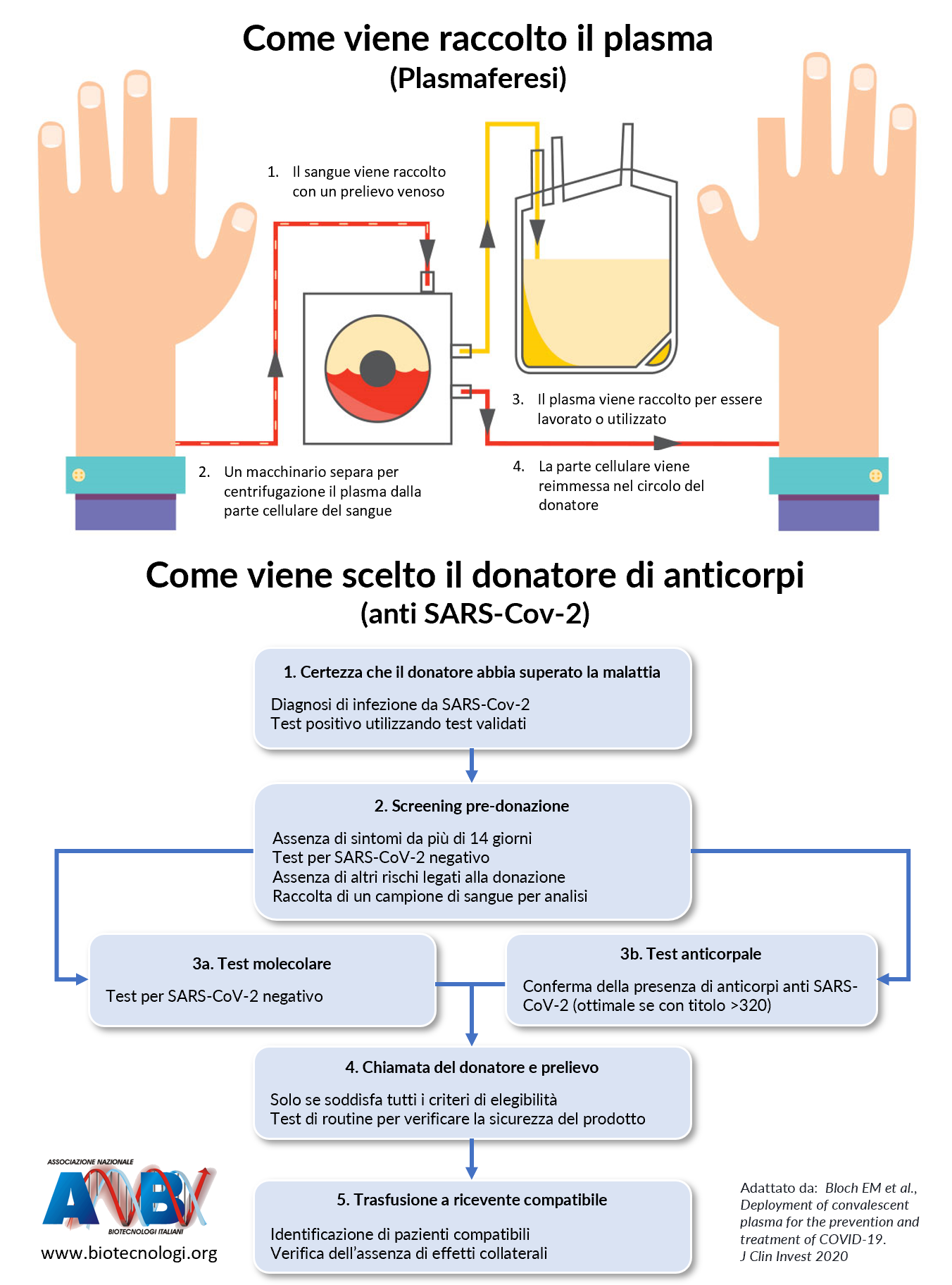
Partiamo dall’inizio. Con “plasma convalescente” si fa riferimento al plasma prelevato, tramite la tecnica della plasmaferesi, da una persona guarita da una malattia e trasfuso in un paziente ancora malato. Il plasma si ottiene per mezzo di un macchinario, chiamato “separatore cellulare” che funziona per centrifugazione o per filtrazione: viene tolta dal sangue la parte non corpuscolata, il plasma, mentre le cellule vengono re-infuse al donatore, si legge su Scienza in rete.
Come spiega Tim Herrera in un articolo sul New York Times, infatti, quando il corpo umano “è esposto a un agente patogeno estraneo, la sua risposta è quella di produrre degli anticorpi”, cioè proteine che si legano e neutralizzano corpi estranei, come virus e batteri. Questi anticorpi, continua il giornalista, “una volta che la persona è guarita (…), rimangono nel plasma per un certo periodo di tempo, pronti a combattere quel virus nel caso ritorni. Questo periodo varia e ogni virus richiede i propri anticorpi. Ciò significa che quelli per la SARS, ad esempio, non sono in grado di bloccare la MERS (ndr, cioè la Sindrome Respiratoria medio-orientale)”.
Questo significa che gli anticorpi formatisi e presenti nel plasma della persona guarita possono aiutare il sistema immunitario di quella malata, “accelerando il tempo necessario per sviluppare il proprio esercito di anticorpi”. Per questo motivo, questa terapia viene definita “anticorpale passiva”, perché una persona non produce autonomamente, cioè in maniera attiva, degli anticorpi, ma li riceve dall’esterno. Come sottolinea l’Avis, bisogna tenere presente però che i criteri di selezione dei donatori di plasma “sono molto stringenti e prevedono una determinata quantità di anticorpi specifici che non tutti i convalescenti hanno”.
 via Associazione Nazionale Biotecnologi Italiani – ANBI
via Associazione Nazionale Biotecnologi Italiani – ANBI
L’utilizzo di questa pratica non è recente, ma ha origine nel 1890. Nel corso dei decenni, una sua possibile efficacia nel migliorare le condizioni dei pazienti, quando non esistono altre possibilità immediate di trattamento, è stata osservata per una serie di infezione virali: nel trattamento del morbillo, della febbre emorragica argentina, dell’influenza, della varicella e più recentemente, della MERS, dell’influenza suina, dell’influenza aviaria, delle infezioni respiratorie acute (SARI) e dell’Ebola in Africa occidentale.
Nonostante una lunga storia di utilizzo del plasma convalescente, specifica un’analisi, la sua efficacia clinica non è stata ancora studiata in modo approfondito e le conclusioni raggiunte nel tempo risultano deboli, “probabilmente perché il plasma convalescente è stato utilizzato in situazioni critiche, durante gravi epidemie, che richiedono azioni immediate”. Inoltre “l’efficacia di questa terapia al plasma convalescente sembra differire a seconda del patogeno e dei protocolli di trattamento (ad es. tempistica, volume e dosaggio della somministrazione)”.
Il problema del “plasma convalescente”, però, per quanto riguarda il nuovo coronavirus, è che non sappiamo ancora con certezza se gli anticorpi prodotti possano essere utili alle altre persone malate. Il dottor. Erin Goodhue, direttore medico esecutivo della Croce Rossa americana, ha sottolineato al New York Times l’importanza dell’attuale ampio uso di questo trattamento. In questo modo, per la prima volta, le comunità mediche e scientifiche potranno condurre degli studi rigorosi per determinarne meglio l’effettivo funzionamento.
La sperimentazione tra Cina, Europa e Stati Uniti
Il primo utilizzo del “sangue convalescente” contro COVID-19 è stato in Cina. La notizia arriva in Italia il 14 febbraio. Il China National Biotec Group, una compagnia privata cinese, informa in un comunicato di aver usato questo trattamento su più dieci pazienti, ottenendo miglioramenti in 24 ore. Secondo la compagnia cinese “in assenza di un vaccino e di terapie specifiche” questa sperimentazione sarebbe “il modo più efficace” per trattare l’infezione e avrebbe ridotto “notevolmente la mortalità dei pazienti critici”.
Il presidente della Società italiana di malattie infettive e tropicali (Simit), Marcello Tavio, commentando la notizia, ha avvertito che i dati a disposizione sono ancora pochi e per questo invitato alla cautela: «È chiaro che dobbiamo prendere con le molle questo tipo di sperimentazioni fatte a caldo, in piena epidemia, su pochi pazienti e con metodi che non possiamo verificare in modo approfondito». Tavio ha però aggiunto che bisogna valutare anche «il lato buono della notizia ovvero il fatto che, se le cose stanno nel modo in cui sono state riferite, gli anticorpi risulterebbero protettivi e questo aumenterebbe di molto la probabilità di avere in tempi ragionevolmente brevi un vaccino che possa effettivamente risolvere il problema alla base».
Pochi giorni dopo, il 17 febbraio, dalla Cina si apprende che un malato di COVID-19, trattato con il “plasma convalescente”, è stato dimesso dall’ospedale della città di Wuhan, primo epicentro dell’epidemia. A renderlo noto è stato Sun Yanrong, funzionario del ministero cinese delle Scienze e della Tecnologia, durante una conferenza stampa nel corso della quale è stato comunicato che in Cina “la prima dose di plasma sanguigno di un paziente ripresosi dalla sindrome COVID-19 è stata raccolta il primo febbraio, mentre questa terapia sperimentale è stata applicata per la prima volta il 9 febbraio a un contagiato in gravi condizioni ricoverato in un ospedale del distretto di Jiangxia a Wuhan”. Sun aggiunge che altri 10 pazienti sarebbero stati sottoposti a questa sperimentazione nei giorni successivi. Verso la fine del mese, Guo Yanhong, funzionario della Commissione Sanitaria ha poi comunicato che la Cina ha offerto una terapia al plasma a 245 pazienti e che in 91 hanno mostrato dei miglioramenti. Il funzionario ha anche specificato che il paese istituirà una task force di esperti a livello provinciale e nazionale per analizzare e migliorare l’uso della terapia.
A metà marzo, poco meno di un mese del primo caso ufficiale di contagio locale a Codogno, viene avviato anche in Italia il primo protocollo con l’obiettivo di poter realizzare questa sperimentazione per aiutare i casi più gravi malati da COVID-19. Si tratta di un’intesa firmata da una serie di centri regionali, fra cui l’Asst (l’ex Asl) di Mantova e il Policlinico San Matteo di Pavia. Massimo Franchini, direttore del Servizio di Immunoematologia e Medicina Trasfusionale del Carlo Poma di Mantova ha spiegato che «nelle gravi epidemie virali per le quali non esistono terapie consolidate l’Organizzazione Mondiale della Sanità ammette l’utilizzo del plasma da pazienti guariti per la cura dei malati».
Cesare Perotti, responsabile del servizio di Immunoematologia e Medicina trasfusionale del San Matteo, ha inoltre dichiarato che il protocollo del San Matteo ha ricevuto il parere favorevole del Centro Nazionale Sangue e del Comitato etico del Policlinico di Pavia e che si attende il via libera dell’Istituto superiore di sanità (ISS). Diversi giorni dopo, Raffaele Bruno, direttore malattie infettive dell’ospedale San Matteo di Pavia, intervistato da Tv2000, ha affermato che la sperimentazione del “plasma convalescente” «non è la soluzione del problema ma un ulteriore aiuto nel cercare di combattere questa malattia». Il 27 marzo arriva poi l’approvazione del Centro Nazionale Sangue dell’Istituto Superiore di Sanità.
Nel frattempo, l’utilizzo di questa terapia si allarga via via anche in altre città e regioni italiane e non solo. Giustina De Silvestro, direttore del servizio trasfusionale dell’Azienda ospedaliera di Padova, dichiara: «Abbiamo deciso di utilizzare il plasma dei pazienti guariti con un’alta quantità di anticorpi contro il coronavirus, per andare a trasfonderlo nei pazienti che sono in una fase di malattia particolarmente severa. L’efficacia di questo plasma è stata confermata recentemente dal confronto coi colleghi di Wuhan, che hanno avuto un’esperienza positiva su un piccolo campionamento di pazienti e poi l’hanno estesa a 300 pazienti». La terapia viene avviata anche in Toscana, a capo di un progetto che coinvolge anche altre quattro Regioni: Lazio, Campania, Marche e Molise. Francesco Menichetti dell’Azienda ospedaliero universitaria pisana, coordinatore e promotore del progetto spiega: «La cura si fonda anche sulla donazione di plasma e la generosità è molto importante visto che ogni donatore può aiutare tre malati critici». Avvio di sperimentazioni vengono anche anche annunciate in Abruzzo, in Puglia e in Umbria.
La sperimentazione parte anche in altri paesi del mondo. Negli Stati Uniti lo scorso 25 marzo la Food and Drug Administration (FDA) – che a oggi non ha ancora approvato ufficialmente l’uso del plasma dei guariti per curare gli infetti perché mancano prove certe sulla sua efficacia – ha fornito precise raccomandazioni nel caso le strutture sanitarie vogliano avviare questa questa terapia per uso “compassionevole”. Come si legge in un articolo su Nature, gli ospedali di New York – città tra le più colpite dall’epidemia – si stanno preparando per usare “questa antica pratica” sperando che possa aiutare a ridurre la pressione sulle terapie intensive. Il ruolo dell’FDA è anche quello di organizzare una partnership tra industria, istituzioni accademiche e agenzie governative per facilitare l’accesso dei pazienti a questa terapia e lo svolgimento di studi clinici ben controllati per valutare rigorosamente la sicurezza e l’efficacia di questo trattamento.
In Francia, l’Agenzia per la Sicurezza dei Medicinali e dei Prodotti Sanitari (ANSM), pur specificando che l’efficacia di questa terapia non è stata ancora dimostrata, fa partire un utilizzo eccezionale e temporaneo del “plasma convalescente”, secondo precisi parametri, per “aumentare le possibilità di sopravvivenza dei pazienti con una forma grave” della malattia. Sperimentazioni vengono avviate anche in Germania, in Regno Unito, in Spagna, inIran, in Corea del Sud e in India.
Viste le speranze nei confronti di questa cura, per via dei primi effetti positivi riscontrati, due case biofarmaceutiche specializzate in terapie plasma-derivate – Kamada Ltd. e Kedrion Biopharma – hanno annunciato a fine aprile la produzione e la distribuzione di una immunoglobulina policlonale umana (IgG) plasma-derivata Anti-SARs-COV-2 (cioè una miscela di anticorpi), come potenziale trattamento per pazienti con Coronavirus. Le due aziende sottolineano al tempo stesso come “non vi sia la certezza che lo sviluppo e la produzione di un’immunoglobulina Anti-SARs-COV-2 avverrà nei tempi sperati e che risulterà una terapia sicura, efficace e autorizzata contro il COVID-19”. Eppure, l’elenco della case farmaceutiche interessate a sviluppare terapie derivate dal plasma non è corto.
In Italia, il ministero della Salute, lo scorso 5 maggio, ha comunicato che “l’uso del plasma da convalescenti come terapia per COVID-19 è attualmente oggetto di studio in diversi paesi del mondo, Italia compresa”. Franco Locatelli, presidente del Consiglio superiore di sanità (Css) e componente del Comitato tecnico scientifico (CTS) sull’emergenza Covid-19, ha affermato che «la comunità scientifica è in trepidante attesa dei risultati della prima sperimentazione, avviata dai colleghi di Pavia e Mantova». Locatelli sottolinea inoltre che «lo studio condotto tra Pavia e Mantova è un lavoro importante. Poi però servirà la validazione dei dati con uno studio clinico controllato. Solo in questo modo avremo dati solidi sull’efficacia di questo approccio».
Plasma convalescente e COVID-19, cosa si sa finora
La sperimentazione partita in Italia a marzo con il protocollo avviato dal’Asst di Mantova e dal Policlinico San Matteo di Pavia ha coinvolto 47 pazienti (gravi) e si è conclusa lo scorso 29 aprile. Attualmente “è in corso l’analisi dei dati raccolti dagli specialisti nell’ambito del progetto e la successiva pubblicazione”, si legge nel comunicato dei due enti. Il lavoro, specifica l’Asst di Mantova, “sarà valutato da una commissione di referees che, secondo la prassi, opereranno in silenzio, autonomia e anonimato per fornire il loro responso”.
Il giorno prima dell’annuncio, Massimo Franchini, responsabile dell’Immunoematologia e Medicina trasfusionale del Poma di Mantova ha raccontato che il lavoro è stato «impegnativo, a partire dalla selezione dei donatori: da 100 potenziali candidati non ne ricaviamo più di 30 adatti. Questo perché dobbiamo avere pazienti guariti da almeno 2 settimane e con tamponi negativi, che non abbiamo co-morbidità e siano idonei a donare il plasma. Insomma, devono essere persone sane, che hanno contratto COVID-19 e sono guarite; inoltre devono avere un livello di anticorpi sufficiente per la donazione». Il dirigente medico ha aggiunto che si è fatto «un lavoro certosino, con una serie di esami per assicurare la sicurezza del plasma», sottolineando che «il plasma prodotto in questo modo è sicuro e la possibilità che trasmetta malattie infettive è pari a zero».
La pratica, infatti, se non inquadrata in procedimenti di sicurezza, potrebbe presentare dei rischi. «Siccome è un prodotto di derivazione umana è un po’ delicato dal punto di vista della regolamentazione. Perché gli emoderivati hanno dei rischi, come l’epatite e gli shock anafilattici», ha sottolineato la virologa Iaria Capua. Inoltre, aggiunge Francesco Vitale, docente d’Igiene all’università di Palermo e responsabile del laboratorio di riferimento regionale per l’analisi dei tamponi del Policlinico, «nel plasma, oltre agli anticorpi, potrebbero esserci anche altri virus che al momento non conosciamo e che potrebbero quindi contagiare il paziente che lo riceve. È esattamente ciò che è accaduto negli anni Ottanta con gli emoderivati infetti, che a volte contenevano il virus dell’epatite C o dell’HIV, che allora erano ignoti. Per questo vengono compiuti controlli molto rigorosi».
Franchini ha anche spiegato che i costi di questa terapia sono contenuti: «Il plasma viene infatti donato gratuitamente. Il costo per la cessione ad altri ospedali è abbastanza basso, attorno ai 172 euro. Considerando che da ogni sacca si ricavano due dosi da infondere nei pazienti, ogni trattamento ha un costo di 86 euro».
In attesa dei dati ufficiali di questa sperimentazione, il 3 maggio Fausto Baldanti, dirigente medico, responsabile del Laboratorio di Virologia Molecolare del policlinico di Pavia, in un’intervista televisiva, ha spiegato che i risultati sono «veramente incoraggianti». Va comunque precisato, spiega al Corriere della sera Giuseppe De Donno, direttore della Pneumologia e dell’Unità di Terapia intensiva respiratoria all’ospedale Carlo Poma di Mantova, che «se la malattia ha lavorato a lungo fino a compromettere la funzionalità degli organi non c’è plasma che tenga. In quel caso la mortalità, resta alta perché la virosi non c’è più e quindi non è più il virus il nemico ma sono i danni prodotti dal virus».
Baldanti sempre in tv ha anche specificato che questa cura «non sarà la soluzione del problema», che invece «arriverà con il vaccino, farmaci specifici oppure con la sintesi di questi anticorpi (nel plasma) prodotti in maniera ingegnerizzata. Ma questo richiede tempo». Come sottolinea infatti l’Avis “risulta molto improbabile pensare di poter guarire tutti i pazienti di coronavirus del mondo attraverso delle trasfusioni di plasma iperimmune che, come detto sopra, deve rispondere a requisiti molto rigidi che non tutti i pazienti guariti hanno. L’obiettivo adesso è di riuscire a ottenere dal plasma dei convalescenti delle immunoglobuline, cioè dei farmaci plasmaderivati ricchi di anticorpi da poter sottoporre ai pazienti. Per raggiungere questo risultato, però, occorrono mesi di ricerca”.
Anche la stessa Asst di Mantova, in una nota, ha specificato che “la terapia con il plasma non è una cura miracolosa, ma uno strumento che insieme ad altri potrà consentirci di affrontare nel modo migliore questa epidemia”. Inoltre, l’Azienda Socio Sanitaria Territoriale della città lombarda ha tenuto a precisare che “mettere in contrapposizione vaccino, test sierologici o virologici, plasma, terapie farmacologiche o terapie di supporto è insensato”. Questa cura infatti è per le persone già infette e in gravi condizioni, mentre il vaccino è una strumento di prevenzione per evitare di contrarre COVID-19.
Sull’utilizzo o meno della pratica e dell’avvio di una sperimentazione non tutti gli esperti concordano. Pierluigi Viale, componente dell’Unità di crisi regionale COVID-19 dell’Emilia Romagna e direttore dell’unità operativa di Malattie Infettive del Policlinico Sant’Orsola di Bologna spiega perché la Regione ha deciso di adottare una linea prudenziale, scegliendo di non utilizzare per il momento questa terapia sui pazienti ricoverati: «Vi sono alcune perplessità di fondo rispetto a tale terapia. Innanzitutto il fatto che non si sappia se gli anticorpi presenti nel siero dei pazienti guariti siano protettivi e per quanto perdurino. Secondariamente, appare azzardato somministrare passivamente anticorpi ad un paziente – specie in una fase di malattia in cui sia possibile utilizzare risorse alternative – fino a quando non sarà chiarito il rischio che COVID-19 possa sfruttare il meccanismo attraverso cui gli anticorpi fungono da vettore di infezione da altro sierotipo virale piuttosto che da fattore protettivo; parliamo di ciò che scientificamente viene denominato antibody-dependent enhancement». «Per tutti questi motivi – conclude l’esperto – l’utilizzo routinario del plasma in pazienti affetti da nuovo Coronavirus dovrebbe avere una rigorosa fase sperimentale e un più lungo follow up prima di essere considerato come una terapia di riferimento».
I risultati delle recenti sperimentazioni nel mondo appaiono finora limitati. Cormac Sheridan ricostruisce su Nature Biotechnology che i primi rapporti giunti dalla Cina, seppur incoraggianti, si basavano su analisi di pochi casi piuttosto che su studi rigorosamente verificati. Il giornalista scientifico continua spiegando che i dati proveniente da ulteriori studi condotti in Cina e in Corea del Sud “stanno iniziando lentamente ad arrivare, ma molti centri clinici non attendono ulteriori prove, vista l’urgenza della crisi e la mancanza di comprovate alternative terapeutiche”.
Il motivo sta nel fatto che questa cura, spiega sempre a Nature Arturo Casadevall, presidente di microbiologia molecolare e immunologia presso la Johns Hopkins University, «è diventata rapidamente l’opzione migliore senza però avere la certezza di un suo reale funzionamento». Detto questo, per l’esperto, è necessario capire in maniera approfondita come utilizzare al meglio questo tipo di terapie. La Johns Hopkins University, ad esempio, sarà uno dei pochi centri che svilupperà una sperimentazione per capire se, al di là degli effetti sui malati gravi da COVID-19, il “plasma convalescente” può conferire un’immunità passiva ai destinatari e quindi avere una funzione di prevenzione. Inoltre, ulteriori prove sulla sicurezza e sull’efficacia di questa cura verranno studiate da un esteso programma avviato negli Stati Uniti che al 30 aprile registrava 7.774 pazienti coinvolti, di cui 3.809 sottoposti già a trasfusione.
Anche in Italia è stato avviato un importante processo di verifica della terapia. L’Istituto Superiore di Sanità e l’Agenzia italiana del farmaco (AIFA) hanno comunicato il 7 maggio di essere impegnati “nello sviluppo di uno studio nazionale comparativo (randomizzato) e controllato per valutare l’efficacia e il ruolo del plasma ottenuto da pazienti guariti da COVID-19 con metodica unica e standardizzata”. Il plasma verrà impiegato per “trattare, nell’ambito di questo studio prospettico, malati affetti da forme severe di COVID-19”. Si tratta di uno studio a cui partecipano diversi centri, a partire da quelli di Mantova e Pavia. L’ISS e AIFA specificano che “questo progetto consentirà di ottenere evidenze scientifiche solide sul ruolo che può giocare l’infusione di anticorpi in grado di bloccare l’effetto del virus”.
Sospensione negli Stati Uniti
Aggiornamento 21 agosto 2020: La Food and Drug Administration (FDA), l’ente governativo statunitense che si occupa della regolamentazione dei prodotti alimentari e farmaceutici, ha sospeso l’approvazione di emergenza per la cura al plasma contro la COVID-19. A riportarlo il New York Times.
La scorsa settimana, proprio mentre la FDA si apprestava a rilasciare un’autorizzazione di emergenza per il plasma come trattamento COVID-19, un gruppo di alti funzionari sanitari federali è intervenuto, sostenendo che i dati emergenti sul trattamento erano troppo deboli.
L’autorizzazione per ora è stata sospesa, intanto che vengono esaminati ulteriori dati. A dirlo H. Clifford Lane, direttore clinico presso il National Institute of Allergy and Infectious Diseases, che ha anche sottolineato che un’approvazione di emergenza potrebbe comunque essere rilasciata in futuro. Gli studi clinici ad oggi non hanno dimostrato se il plasma può aiutare le persone a combattere il nuovo coronavirus.
Secondo il NYT, diversi alti funzionari sanitari – tra cui il Dr. Collins, il direttore del National Institutes of Health, Il dottor Fauci, il massimo esperto di malattie infettive del governo e il dottor Lane – hanno esortato i loro colleghi la scorsa settimana alla cautela, citando i dati recenti del più grande studio sul plasma del paese, condotto dalla Mayo Clinic: i dati dello studio non sono abbastanza solidi da giustificare un’approvazione di emergenza.
“Noi tre siamo d’accordo sull’importanza di dati robusti attraverso studi di controllo randomizzati, e sul fatto che una pandemia non cambia questa procedura”, ha detto il dottor Lane. La bozza dell’autorizzazione di emergenza si è basata sulla storia dell’uso del plasma in altre epidemie di malattie e sulla ricerca sugli animali e su una serie di studi sul plasma, incluso il programma della Mayo Clinic, che ha somministrato infusioni a più di 66.000 pazienti con Covid-19 grazie al finanziamento del governo federale.
Diversi funzionari sanitari, scrive il NYT, hanno espresso privatamente preoccupazione per la rapida crescita del programma Mayo e la fretta nel dichiarare il plasma efficace senza avere risultati di studi randomizzati (regola aurea per gli scienziati). La partecipazione imponente al programma ha scatenato un dibattito tra i ricercatori sul tipo di certezza empirica necessaria per il trattamento dei pazienti in un’emergenza sanitaria pubblica.
Un’approvazione di emergenza ora, senza avere la conferma di studi solidi randomizzati, “cambierebbe il modo in cui le persone vedono gli studi”, ha detto la dottoressa Mila B. Ortigoza, specialista in malattie infettive presso N.Y.U. Langone Health che ha avviato una sperimentazione con i colleghi del Montefiore Medical Center. “Vogliamo essere sicuri che quando diciamo che funziona, ne siamo davvero certi, con prove indiscutibili. Abbiamo a che fare con la vita delle persone qui”.
La Mayo Clinic ha già pubblicato analisi su decine di migliaia di pazienti, che dimostrano che il plasma è sicuro. I dati più recenti, che includono più di 35.000 pazienti con Covid-19, molti dei quali in terapia intensiva e ventilatori, suggeriscono che il plasma somministrato entro tre giorni dalla diagnosi riduce i tassi di mortalità. A un mese dalle infusioni, risulta che il tasso di mortalità dei pazienti che hanno ricevuto plasma entro tre giorni dalla diagnosi era inferiore (21,6%) rispetto a quelli che avevano ricevuto plasma successivamente ai tre giorni (26,7%). Ma lo studio non ha avuto un gruppo di controllo di pazienti a cui è stato somministrato placebo da confrontare con quelli a cui è stato somministrato plasma, rendendo difficile per gli scienziati valutare se il trattamento ha funzionato davvero. E data la limitata disponibilità di plasma, non è chiaro quanto sarebbe realistico trattare i pazienti entro tre giorni dalla diagnosi.
Ma un’autorizzazione di emergenza potrebbe avere l’effetto non voluto di rendere più difficile rigorosi studi clinici per dimostrare definitivamente se il plasma funziona. Gli scienziati hanno avuto difficoltà a reclutare pazienti per studi randomizzati, perché molti pazienti e i loro medici – sapendo di poter ricevere il trattamento nell’ambito del programma Mayo – non erano disposti a rischiare di ricevere placebo.
Il mese scorso, uno di questi studi nei Paesi Bassi – riporta sempre il NYT – è stato interrotto quando i ricercatori si sono resi conto che i pazienti trattati con plasma non mostravano differenze in termini di mortalità, durata della degenza ospedaliera o gravità della malattia rispetto a quelli trattati con placebo.
Intanto a fine luglio è stato pubblicato sulla rivista Haematologica lo studio pilota sul plasma iperimmune, firmato dai primari del Poma, Massimo Franchini e Giuseppe De Donno insieme ad altri colleghi del San Matteo di Pavia.
Lo studio ha osservato 46 pazienti dal 25 marzo al 21 aprile 2020. I pazienti avevano 63 anni, il 61% erano maschi, 30 dei quali erano stati sottoposti a Cpap (maschera per la ventilazione) e 7 intubati. Tre pazienti (6,5%) sono deceduti (due erano anche oncologici) entro 7 giorni rispetto al 15% previsto dalle statistiche nazionali e al 30% da una piccola coorte simultanea di 23 pazienti. Lo svezzamento da Cpap è stato ottenuto in 26/30 pazienti e 3 su 7 sono stati estubati. Cinque eventi avversi gravi si sono verificati in 4 pazienti (2 probabili, 2 possibili correlati al trattamento).
Tra le conclusioni del lavoro pubblicato su Haematologica si legge: «Il nostro studio presenta alcune limitazioni, in primo luogo la mancanza di un braccio di controllo randomizzato. In conclusione, siamo stati in grado di mostrare un promettente beneficio del plasma iperimmune nei pazienti Covid-19, sia attraverso una riduzione della mortalità, un aumento della funzione respiratoria e una diminuzione della indici infiammatori. Questa è una prova del concetto di studio, quindi questi risultati non devono essere interpretati in modo eccessivo e l’efficacia non può essere ancora sostenuta. Tuttavia, aprono la strada agli sviluppi futuri compresa la rigorosa dimostrazione dell’efficacia del plasma iperimmune in uno studio clinico randomizzato, e forse, la necessità per il sistema bancario al plasma iperimmune di anticipare una potenziale seconda ondata di pandemia, lo sviluppo di prodotti farmaceutici standardizzati a partire dall’anticorpo purificato frazione (concentrazione di Covid-19 H-Ig) e, almeno ma non ultimo, la produzione di anticorpi monoclonali su larga scala».
Titolo originale dell’articolo: La FDA statunitense ha sospeso l’approvazione di emergenza per la cura al plasma contro la COVID-19. Intanto è stato pubblicato lo studio pilota italiano sul plasma iperimmune
